嘉逸医药高难度仿制药利伐沙班片(逸乐通) 获得药品批件并视同通过一致性评价
2020年9月11日,嘉逸医药高难度仿制药利伐沙班片(商品名:逸乐通)的药品批准证明文件获得国家药品监督管理局公示发布。
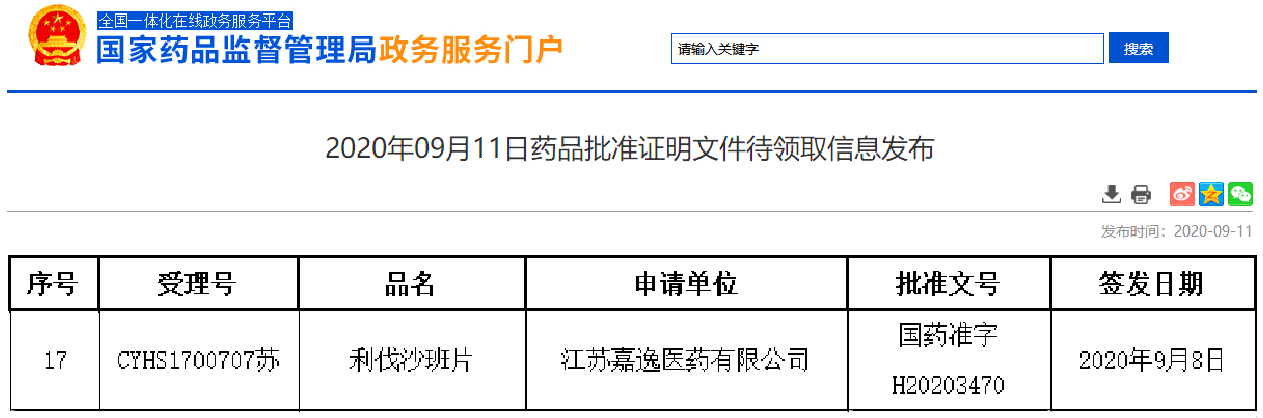
利伐沙班片曾连续三年位列全球小分子药销量前五,这一重磅品种目前国内只有原研在市场销售,尚未有仿制药上市。包括嘉逸医药在内的利伐沙班片仿制药的获批,将打破原研在国内的垄断地位。嘉逸医药的利伐沙班片在国内第一梯队第5位获得药品批准证明文件并视同通过一致性评价,将在原研化合物专利过期后上市销售。嘉逸医药自研自产的原料药利伐沙班也同步通过关联审评审批,获准在上市制剂中使用。
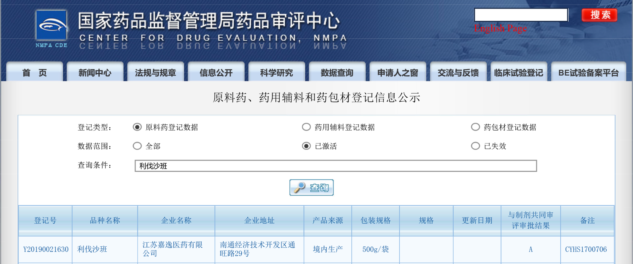
利伐沙班,国内抗凝药物销冠
利伐沙班片是全球2018、2018、2019年连续三年全球五大小分子畅销药物。2019年利伐沙班全球销售额超过69亿美元,其中强生负责的美国市场销售额为23.13亿美元,稍有下滑;拜耳销售额达41.26亿欧元,增长13.63%(折合45.94亿美元)。
根据拜耳和巴莱克资本公司的预测,至2020年全球抗凝药物市场将达200亿美元,新口服Xa因子抑制剂市场份额将达150亿美元。目前国内沙班类药物以进口垄断为主,利伐沙班国内年销售额已经突破20亿元人民币,远超同类治疗药物。
随着国内仿制品种的上市,预计到2026年中国沙班类药物需求规模将达人民币274.8亿元,利伐沙班将在其中占据主要份额。
风靡全球的高效抗凝好药——利伐沙班
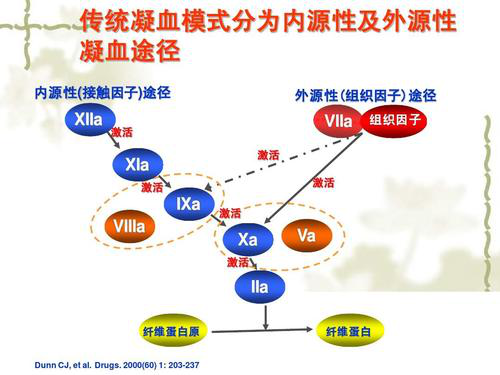
嘉逸研发团队专家介绍,利伐沙班是一种新型口服抗凝药,主要通过抑制凝血因子Xa的活性,进而减少凝血酶(凝血因子Ⅱa)生成发挥抗凝作用,不影响已生成的凝血酶活性。 目前,利伐沙班已广泛用于静脉血栓栓塞性疾病的预防与治疗,以及非瓣膜性房颤的卒中预防。与同类药物华法林相比,利伐沙班具有起效迅速,疗效可预测,颅内出血发生率低,无需常规凝血监测和常规调整剂量等优势。
利伐沙班原研由拜耳/强生联合开发,商品名为Xarelto 。强生负责美国市场,拜耳负责美国以外的全球其他市场。利伐沙班最早于2008年9月获得欧盟批准上市,上市之后很快取代了华法林在欧洲的市场。2009年3月,利伐沙班在国内获批上市,商品名为拜瑞妥。
目前,利伐沙班在中国获批适应症如下: 1.用于择期髋关节或膝关节置换手术成年患者,以预防静脉血栓形成(VTE)。2.用于治疗成人静脉血栓形成(DVT),降低急性DVT后DVT复发和肺栓塞(PE)的风险。3.用于具有一种或多种危险因素(例如:充血性心力衰竭、高血压、年龄≥75岁、糖尿病、卒中或短暂性脑缺血发作病史)的非瓣膜性房颤成年患者,以降低卒中和全身性栓塞的风险。
另外,其2013年5月于欧洲EMA获批ACS适应症:用于生物标志物确诊的成年急性冠脉综合征(ACS)患者的二级预防。适应证剂量为2.5mg,每天两次与标准抗血小板治疗联用。2018年于欧洲EMA和美国FDA获批CAD/PAD新适应症,即EMA为利伐沙班 2.5mg 一天两次联合阿司匹林75-100mg 一天一次用于治疗高缺血风险的冠状动脉疾病或者症状性外周动脉疾病成人患者,以预防动脉粥样硬化血栓性事件发生,FDA为利伐沙班 2.5 mg 一天两次联合低剂量阿司匹林一天一次用于冠状动脉疾病或者症状性外周动脉疾病患者,以降低主要心血管事件(卒中、心血管死亡和心肌梗死)发生风险。
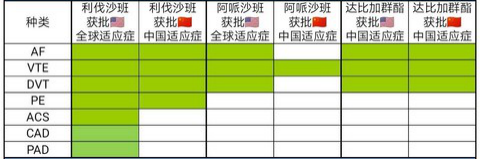
新一代口服抗凝药物获批适应症比较
嘉逸医药挑战难度,研发利伐沙班原料药及其制剂
秉承“让老百姓及早用上放心好药”的企业使命,嘉逸医药立志为国内患者解决用药可及性难题。我们于2014年决定立项开发逸乐通。2016年开展BE研究(临床试验登记号CTR20160596和CTR20170773),是国内药企中最早完成利伐沙班这一高难度BE试验的企业。2018年10月9日,我们的逸乐通项目以化药新注册分类4类申报生产并获得总局药品审评中心(CDE)受理(受理号CYHS1700707苏);2020年8月通过国家药品监督管理局公示的“药品批准证明文件待领取信息发布”确认获得注册批件。逸乐通研发团队专家表示,逸乐通上市后,将使更多患者获得更好的治疗,增加药物可及性,使患者能够用得起疗效好、品质佳的优质药物。
关于嘉逸医药
嘉逸医药以仿制小分子化药见长,首仿研发能力突出,积极响应国家号召,进行重大、多发性疾病防治需求的通用名药物首次开发和生产,目前拥有内分泌、心血管等药物管线40余个。嘉逸医药目前已报产和上市药品管线全部为原料药自研自产,质量稳定可靠。
嘉逸医药首仿药物盐酸西那卡塞片已经于2020年4月获得药品批件并上市销售,阿哌沙班片已经获得第三批国家集采中标,其他已报产重磅品种如安立生坦、伐尼克兰等均已进入生产审批冲刺阶段。
免责声明:本文所有内容仅供读者参考,不构成用药建议,不可代替专业医师诊断、不可代替医师处方,请谨慎参阅。山西amjs澳金沙门医药集团和江苏嘉逸医药有限公司不承担由此引起的任何相关责任。
